미국 존슨앤드존슨의 제약 자회사 얀센이 개발하고 있는 코로나19 백신의 효능이 최대 72%로 나타났다. 로이터 연합뉴스
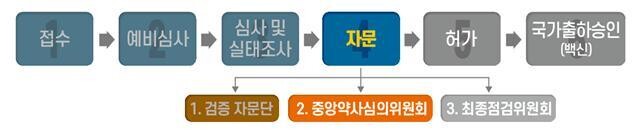
1회 접종으로 개발된 존슨앤드존슨의 자회사 얀센의 코로나19 백신이 식품의약품안전처의 중앙약사심의위원회 심사에서도 ‘허가 가능’ 판단을 받았다. 국내에서 품목 허가를 얻기 위한 3단계의 전문가 자문 절차 가운데 2번째 자문까지 무사 통과한 것으로, 조만간 정식 허가가 나올 것으로 보인다.
식약처는 1일 오전 중앙약사심의위가 회의를 열고 ㈜한국얀센이 ‘코비드-19백신 얀센주’의 품목허가 신청을 위해 제출한 자료를 두고 안전성과 효과성을 논의했다고 밝혔다. 이날 회의에는 외부 전문가 17명과 식약처 내부 8명이 참석했다.
논의 결과 이들은 “신청 품목의 코로나19 예방 목적의 필요성이 인정돼 품목허가 할 수 있다”며 “다만 장기유효성에 관한 자료는 추적 관찰할 것”이라고 자문했다. 얀센 쪽이 제출한 자료에서 18살 이상에 1회 투여 시 14일 뒤 66.9%, 28일 뒤 66.1%의 예방효과가 확인되었다. 세계보건기구(WHO) 등이 정한 기준 50%를 상회하는 예방효과다. 안전성에 대해서는 임상시험 중 발생한 이상사례 등을 살폈을 때 “허용할 수 있는 수준”이라고 판단했다.
코로나19 백신에 대한 국내 품목허가 심사 과정. 식약처 제공
이날 중앙약사심의위에서도 허가 가능 판단이 나온 만큼, 식약처는 이른 시일 안에 마지막 절차인 ‘최종점검위원회’를 개최해 허가를 낼 것으로 보인다. 얀센 백신은 코로나19 바이러스 표면 항원 유전자를 침팬지에게만 감염되는 아데노바이러스 주형에 넣어 제조한 ‘바이러스 벡터 백신’이다. 현재 국내 접종에 폭넓게 쓰이는 아스트라제네카 백신과 플랫폼이 같다. 국내에 도입이 예정된 백신은 모두 600만명분이나, 구체적인 도입 일정은 확정되지 않았다.
최하얀 기자
chy@hani.co.kr